在医药领域,药品全生命周期一般理解为从药品研发、上市前注册、上市后定价与报销、上市后使用、上市后再评价直至由于安全性等原因退市的整个过程。罕见病药物全生命周期符合上述过程。2015年后,我国罕见病药物保障在全生命周期不同阶段有哪些政策?本文做了梳理。
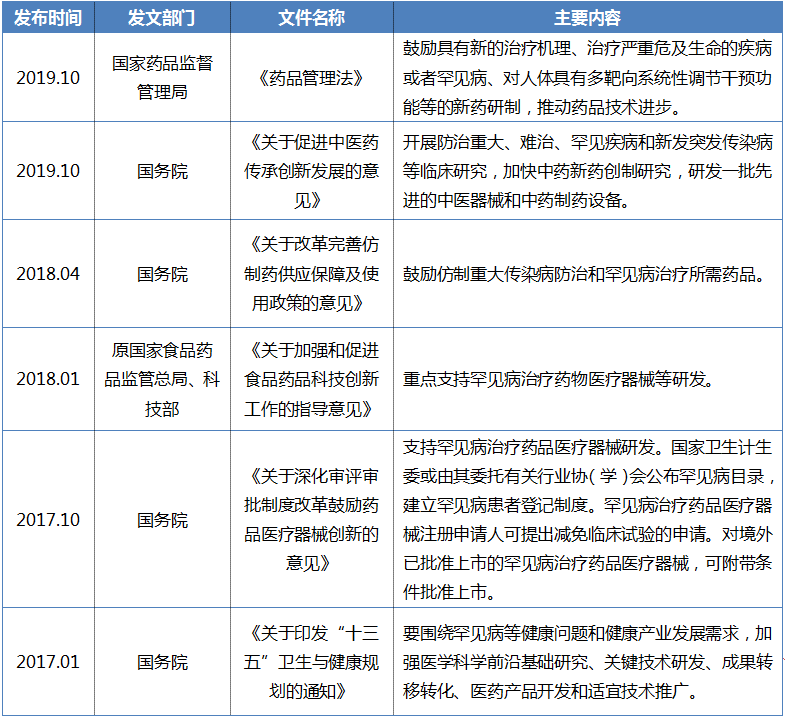
详细内容良好的药物研发政策是激励药物创新的重要动力之一,能够加快创新药物的早日上市,减少患者的疾病痛苦。罕见病药物最大的特点就是临床急需供应不足。因此,罕见病药物研发政策的出台,必将提高患者的药物可及性。如表1所示,近年来,我国政府对罕见病药物创新的激励政策明显增加。
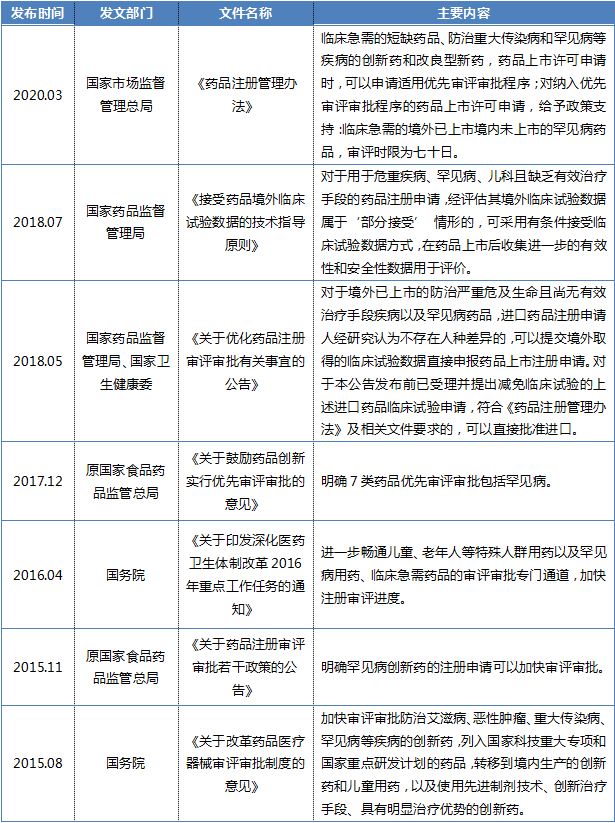
在注册阶段,基于药品安全有效的前提下,高效快速的审批流程,能够使患者提前使用急需的药品,这在罕见病药物领域是至关重要的。不仅能够减轻患者的疾病痛苦、提高生活质量,更能够挽救患者的生命。因此,罕见病药物注册阶段政策的制定实施,起到了药品上市“加速器”的作用。
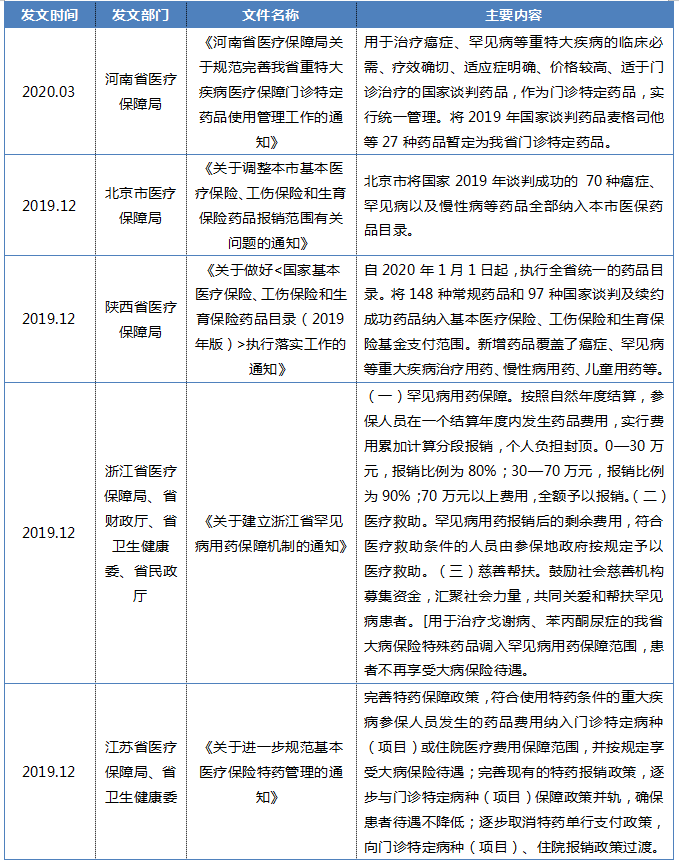
4月29日,由国家医保局出台的《基本医疗保险用药管理暂行办法(征求意见稿)》,第十二条规定同步确定医保支付标准,建立《药品目录》准入与医保药品支付标准(以下简称支付标准)衔接机制。除中药饮片外,原则上新纳入《药品目录》的药品同步确定支付标准。这一条款表明药品的定价将与进入医保报销相结合,同步完成。
药品的价格、是否报销及报销的具体政策等直接影响患者药品的可及性,也就是通常提到的药品可支付性问题。为了减轻罕见病患者用药的负担,国家及省市级层面出台了不同层次的保障措施。
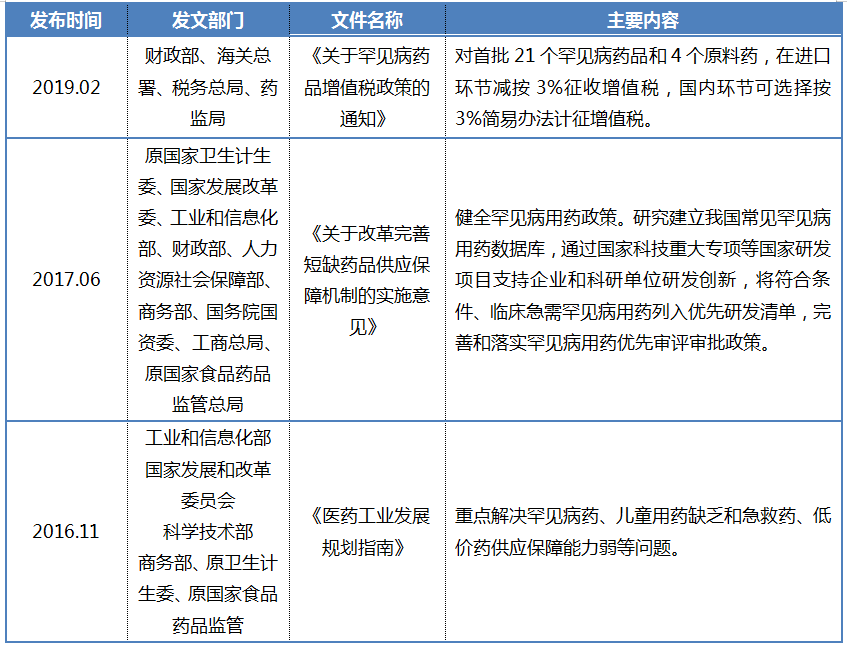
罕见病药物经常与短缺药品相挂钩,针对这一类药品不仅要有药可医、负担得起,更要保障其市场供应。近年来,中国多部位联合出台了相关政策,以保证罕见病药物的供应。
罕见病药物的注册审批过程中由于其本身的特殊性,通常符合优先审评审批、附条件上市等加速上市的条件。在此种情况下,其上市后的数据收集和监管就显得尤为必要和重要。针对罕见病药物的安全性,应按照药物警戒的要求,进行全生命周期管理。目前,作者还没有检索到专门我国针对罕见病药物上市后监管政策的出台,但在对一般药品的上市监管上,国家药监局已经做了相应的部署。2020年药品注册管理和上市后监管工作会议中,就明确了2020年药品上市后监管的重点任务,其中提到强化企业责任落实,坚持问题导向、风险防控,不断强化监督检查,提升抽检效能,加快推进药物警戒制度。
罕见病的确诊是罕见病药物得以合理使用的必要提前条件。然而,目前罕见病的知晓率低、误诊率高、治疗可及性差等诊疗现状,却一直困扰着绝大多数的罕见病患者。因此,提高医生对罕见病的诊疗水平,使罕见病患者能够早诊断、早治疗,不仅仅医疗问题,也关系到药品全生命周期的使用环节。
罕见病药物保障政策应涉及药物从研发到上市使用乃至退市的各个环节,不是一个部门可以独自解决的,需要多部门全方位共同协作的政策保障。在多部门合作的前提下,建议国家成立罕见病及其药物保障的专职部门,类似于国外的罕见病国家计划委员会,统筹合作,为罕见病患者提供多元化的保障措施。
原文:食事药闻APP 袁妮
更详细介绍请关注公众号文章【原文链接】


1 个回复
七色 堇
在医药领域,药品全生命周期一般理解为从药品研发、上市前注册、上市后定价与报销、上市后使用、上市后再评价直至由于安全性等原因退市的整个过程。罕见病药物全生命周期符合上述过程。2015年后,我国罕见病药物保障在全生命周期不同阶段有哪些政策?本文做了梳理。
详细内容
1. 药物研发阶段
良好的药物研发政策是激励药物创新的重要动力之一,能够加快创新药物的早日上市,减少患者的疾病痛苦。罕见病药物最大的特点就是临床急需供应不足。因此,罕见病药物研发政策的出台,必将提高患者的药物可及性。如表1所示,近年来,我国政府对罕见病药物创新的激励政策明显增加。
2. 药物注册阶段
在注册阶段,基于药品安全有效的前提下,高效快速的审批流程,能够使患者提前使用急需的药品,这在罕见病药物领域是至关重要的。不仅能够减轻患者的疾病痛苦、提高生活质量,更能够挽救患者的生命。因此,罕见病药物注册阶段政策的制定实施,起到了药品上市“加速器”的作用。
3. 药物定价与报销阶段
4月29日,由国家医保局出台的《基本医疗保险用药管理暂行办法(征求意见稿)》,第十二条规定同步确定医保支付标准,建立《药品目录》准入与医保药品支付标准(以下简称支付标准)衔接机制。除中药饮片外,原则上新纳入《药品目录》的药品同步确定支付标准。这一条款表明药品的定价将与进入医保报销相结合,同步完成。
药品的价格、是否报销及报销的具体政策等直接影响患者药品的可及性,也就是通常提到的药品可支付性问题。为了减轻罕见病患者用药的负担,国家及省市级层面出台了不同层次的保障措施。
4. 药物供应阶段
罕见病药物经常与短缺药品相挂钩,针对这一类药品不仅要有药可医、负担得起,更要保障其市场供应。近年来,中国多部位联合出台了相关政策,以保证罕见病药物的供应。
5. 药物上市后监管阶段(药物警戒)
罕见病药物的注册审批过程中由于其本身的特殊性,通常符合优先审评审批、附条件上市等加速上市的条件。在此种情况下,其上市后的数据收集和监管就显得尤为必要和重要。针对罕见病药物的安全性,应按照药物警戒的要求,进行全生命周期管理。目前,作者还没有检索到专门我国针对罕见病药物上市后监管政策的出台,但在对一般药品的上市监管上,国家药监局已经做了相应的部署。
2020年药品注册管理和上市后监管工作会议中,就明确了2020年药品上市后监管的重点任务,其中提到强化企业责任落实,坚持问题导向、风险防控,不断强化监督检查,提升抽检效能,加快推进药物警戒制度。
6. 其他相关政策(罕见病诊疗阶段)
罕见病的确诊是罕见病药物得以合理使用的必要提前条件。然而,目前罕见病的知晓率低、误诊率高、治疗可及性差等诊疗现状,却一直困扰着绝大多数的罕见病患者。因此,提高医生对罕见病的诊疗水平,使罕见病患者能够早诊断、早治疗,不仅仅医疗问题,也关系到药品全生命周期的使用环节。
罕见病药物保障政策应涉及药物从研发到上市使用乃至退市的各个环节,不是一个部门可以独自解决的,需要多部门全方位共同协作的政策保障。在多部门合作的前提下,建议国家成立罕见病及其药物保障的专职部门,类似于国外的罕见病国家计划委员会,统筹合作,为罕见病患者提供多元化的保障措施。
原文:食事药闻APP 袁妮
更详细介绍请关注公众号文章。