FDA加速审批AAV基因疗法,Passage开发的儿科罕见病药物获多个称号后股票大涨
FDA加速审批AAV基因疗法,Passage开发的儿科罕见病药物获多个称号后股票大涨丨医麦猛爆料
出处:康康 医麦客 5.25
2020年5月25日/医麦客新闻 eMedClub News/--上个月,致力于开发AAV基因疗法的Passage Bio宣布,美国FDA授予其主要候选药物PBGM01 “孤儿药” 称号,用于治疗婴儿型GM1神经节苷脂贮积症(GM1 gangliosidosis)。
Passage Bio公司官网
出处:康康 医麦客 5.25
2020年5月25日/医麦客新闻 eMedClub News/--上个月,致力于开发AAV基因疗法的Passage Bio宣布,美国FDA授予其主要候选药物PBGM01 “孤儿药” 称号,用于治疗婴儿型GM1神经节苷脂贮积症(GM1 gangliosidosis)。
• 更高的产量:与PEIpro®比,AAV产量可增加2-3倍• 复合物稳定性好: 可延长至6小时• 工作体积减小:由10%减至1%• DNA用量减少: 可减少25%• 灵活性: 兼容商业化细胞培养基• FectoVIR®-AAV:严格的生产和质控标准• GMP级产品:正在开发中
Passage Bio公司官网
1 个评论
FDA加速审批AAV基因疗法,Passage开发的儿科罕见病药物获多个称号后股票大涨丨医麦猛爆料
出处:康康 医麦客 5.25
2020年5月25日/医麦客新闻 eMedClub News/--上个月,致力于开发AAV基因疗法的Passage Bio宣布,美国FDA授予其主要候选药物PBGM01 “孤儿药” 称号,用于治疗婴儿型GM1神经节苷脂贮积症(GM1 gangliosidosis)。
一个月后,又传来PBGM01获得FDA授予的罕见儿科疾病(RPD)称号的消息,广泛用于治疗GM1神经节苷脂贮积症。PBGM01是一款AAV基因疗法,目前正在开发用于治疗婴儿型GM1神经节苷脂贮积症。
Passage Bio首席执行官Bruce Goldsmith表示:“这是我们从FDA获得的第二个关于GM1神经节苷脂贮积症的监管称号,反映了该患者群体的高度未满足需求。我们相信PBGM01具有改变生命的潜力。我们期待着今年晚些时候将PBGM01投入临床试验。”
RPD称号针对的是主要影响18岁及以下且影响人群不足20万的严重、危及生命的疾病。该项目旨在鼓励开发用于预防和治疗罕见儿科疾病的新药和生物制剂。如果PBGM01的生物制品许可申请(BLA)获得批准,Passage Bio将有资格获得优先审评券(PRV),该券可以兑换以获得任何后续新药申请的优先审查,并且可以出售或转让。
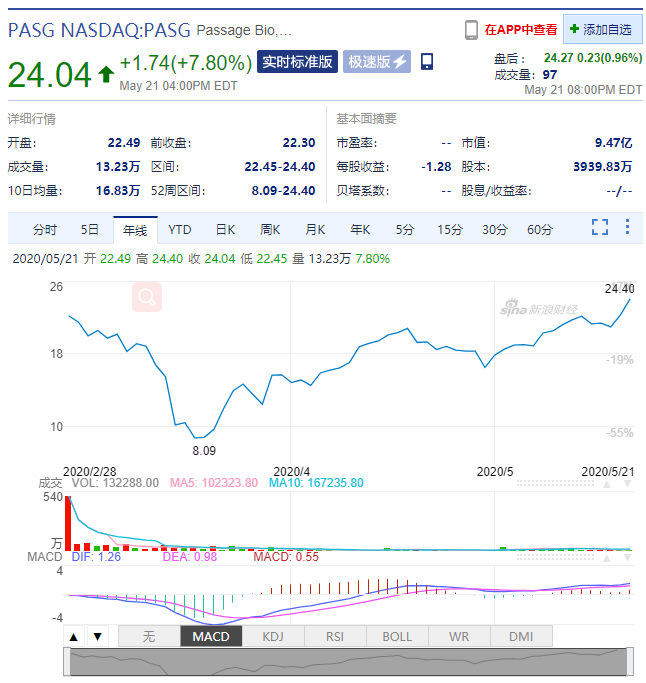
在该消息宣布当天,Passage Bio的股票(纳斯达克股票代码:PASG)高涨7.80%,至24.04美元。从下图来看,从四月开始,该公司的股票一直处于上涨趋势。
PBGM01治疗GM1的机制
GM1神经节苷脂贮积症(GM1 gangliosidosis)是一种常染色体隐性遗传疾病,由GLB1基因突变导致其编码的溶酶体酶β-半乳糖苷酶(β-gal)缺乏引起。β-gal是GM1神经节苷脂和硫酸角质素降解所必需的酶,β-gal水平的降低会导致整个大脑神经元中GM1神经节苷脂的毒性水平的积聚,从而导致疾病迅速发展。
婴儿型GM1是该疾病的最常见和严重形式,通常发生4个月时的步态异常和6个月时的发育退化。患有该病的婴儿大约在2岁时经历迅速致命退化,预期寿命为2-4岁。
PBGM01是一款正在开发的AAV基因疗法,用于治疗婴儿型GM1。PBGM01通过ICM注射(注射进颅颈交界处的小脑延髓池)给药,利用AAVhu68衣壳将具有编码β-gal功能的GLB1基因递送至大脑及周围组织。
PBGM01通过增加β-gal水平,从而减少GM1神经节苷脂的积累,PBGM01具有逆转神经元毒性的潜力,从而使GM1婴儿恢复发育。在临床前模型中,PBGM01在大脑的广泛分布,以及在中枢神经系统(CNS)和关键周边器官中β-gal的广泛吸收,显示了PBGM01对GM1的治疗潜力。
Passage Bio计划在2020年第四季度开始PBGM01治疗婴儿GM1进行1/2期临床试验。
值得关注的AAV候选产品
Passage Bio专注开发以腺相关病毒(AAV)为载体的基因疗法,用来治疗由单基因缺陷引起的中枢神经系统(CNS)罕见病。目前,Passage Bio拥有6个候选产品,其中最为先进的计划是GM1神经节苷脂贮积症、额颞叶痴呆和Krabbe病(又称球形细胞脑白质营养不良,GLD)。
除了进展较快的PBGM01,日前,该公司于美国基因与细胞治疗学会(ASGCT)第23届年会上公布了其针对Krabbe病的项目PBKR03的动物模型数据。
球形细胞脑白质营养不良(GLD),于1916年由Krabbe首先报道,因此又称Krabbe病,是一种罕见的常染色体隐性遗传病。Krabbe病是由于GALC基因突变导致溶酶体内半乳糖脑苷脂酶缺乏,引起半乳糖脑苷脂大量沉积于脑内,继发产生鞘氨醇半乳糖苷毒性作用,造成中枢及周围神经系统广泛髓鞘脱失、星形胶质细胞增生以及广泛的多核巨噬细胞浸润,从而引起一系列的相应临床表现。
根据发病年龄分为早发婴儿型和晚发型,婴儿型Krabbe病通常在婴儿六个月大以前出现,是最常见最严重的形式。Passage Bio公司预测Krabbe病的发病率大约为每10万新生儿中有2.6例,高于目前报道的发病率水平。目前尚无批准的治疗方法。
PBKR03是一款正在开发中的AAV基因疗法,用于治疗婴儿型Krabbe病,PBGM01通过ICM注射(注射进颅颈交界处的小脑延髓池)给药,利用下一代AAVhu68衣壳将能够编码半乳糖脑苷脂酶的GALC基因递送至大脑及周围组织。
在出现抽搐的Krabbe小鼠模型中,PBKR03治疗后,显示半乳糖脑苷脂酶活性明显增加,且周围神经髓鞘改善、神经运动功能的改善和存活率的提高。而在天然的Krabbe犬类模型中,单次ICM注射给药携带GALC的AAVhu68后,表现出半乳糖脑苷脂酶活性正常化、脑脊液中精神氨酸水平降低、周围神经传导速度恢复正常、髓鞘改善、脑炎减少、表型校正和存活率提高。
在小鼠和犬类模型中,均显示耐受性良好,未观察到毒副作用。
Passage Bio的联合创始人兼首席科学顾问James M. Wilson 博士表示:“这些数据展示了在功能上的表型改善和最终延长的生存期,表明ICM给药基因疗法可能是有效的罕见中枢神经系统疾病的治疗方式,例如Krabbe病。”
另外,该公司表示将在2020年下半年提交PBKR03的IND,并在2021年上半年启动1/2期试验。
Passage Bio 来头不小
AAV大牛 James M. Wilson 博士是Passage Bio的联合创始人之一,Wilson博士是宾夕法尼亚大学(以下简称宾大)医学院教授,他的团队已在基因治疗领域做出了重要贡献,并且20多年来一直处于AAV研究的前沿。
曾担任过SmithKline-Beecham(现为GlaxoSmithKline)首席科学官的Tachi Yamada也是Passage Bio的联合创始人之一。另一位拥有超过25年的生物技术行业经验,同时也是奥博资本的风险合作伙伴的Stephen Squinto博士也是该公司的联合创始人。
Passage Bio与宾夕法尼亚大学(UPenn)的基因治疗项目(Gene Therapy Program,GTP)签署了研究、合作和许可协议,宾大负责临床前工作,然后将基因疗法交给Passage进行临床测试并最终商业化。
如今,这家生物科技公司正与它的学术伙伴进一步加深合作关系。5月7日,Passage Bio和GTP宣布扩大合作协议,包括额外的五个项目,并将Passage Bio的期限延长为三年(到2025年),以实施新项目。
此外,Passage Bio将为GTP的发现研究提供资金,并且在一定限制情况下,将获得与GTP一起开发的Passage Bio产品发现计划所产生的技术的专有权,例如新型衣壳,降低毒性的技术以及递送和配方改进。
此外,2019年2月,Passage Bio作为一家新锐基因疗法公司首次亮相就获得了奥博资本领投的1.15亿美元A轮融资;同年9月,获得由Access Biotechnology领投的1.1亿美元的B轮融资;2020年2月,Passage Bio于纳斯达克上市,将发行价定在最高18美元,从IPO中获得2.16亿美元。
为顺利推进各项候选产品的临床开发,2019年7月10日,Passage Bio还与Paragon Gene Therapy签订了合作协议,Paragon开发的一组专用的cGMP制造设施预计将于2020年下半年投入使用,支持Passage Bio的AAV基因治疗产品从临床到商业供应。
AAV的潜力及未来商业化的考量
腺相关病毒(AAV)最早是在20世纪60年代中期从实验室腺病毒(AdV)制剂中发现的,并且很快就在人体组织中发现。AAV具有无致病性、高效的长期基因表达、易于基因操作以及免疫反应低(或在许多情况下缺乏)的特点,这一系列特性使其成为基因递送的重要工具。
目前,三款以重组AAV为载体的基因治疗药物已经获批上市,它们是UniQure公司开发的Glybera(AAV1),SparkTherapeutics公司开发的Luxturna(AAV2)和诺华公司开发的Zolgensma(AAV9);另外还有一款治疗A型血友病的AAV基因治疗药物BMN-270(来自BioMarin)也提交了上市申请。由此我们可以看出AAV 基因疗法的潜力是巨大的。
同时,AAV也是目前临床上最常使用的病毒载体,而考虑到未来存在的产品商业化,任何一个基于AAV开发药物的开发商都需要大规模的rAAV病毒载体培养系统,同时大体系培养也是保证高产量和可靠的rAAV病毒载体制造过程商业化的关键。
大规模rAAV病毒载体的制造依赖于稳健的大规模瞬时转染过程。大规模的瞬时转染意味着需要制备大量的转染复合物,并在给定的时间内添加到悬浮细胞中,才能使转染有效。
但是大量的转染复合物又会导致最终细胞培养体积的增加、转染时间的增加、病毒滴度产量的不稳定。但是享有“转染专家”的美誉的法国 Polyplus-transfection 最新推出了一款转染试剂FectoVIR® -AAV,有助于解决rAAV生产中的限制。
新型病毒载体生产工具
FectoVIR® -AAV是法国 Polyplus-transfection 公司最新研发的一种基于化学成分且不含动物源的阳离子纳米技术的转染试剂,专为悬浮细胞体系规模化生产AAV而开发,可用在基因和细胞治疗领域。FectoVIR® -AAV适用于各种规格的摇瓶、转瓶、细胞培养袋和生物反应器中无血清悬浮培养的DNA转染,且兼容在细胞培养过程中抗生素的使用。
产品特性:
• 更高的产量:与PEIpro®比,AAV产量可增加2-3倍
• 复合物稳定性好: 可延长至6小时
• 工作体积减小:由10%减至1%
• DNA用量减少: 可减少25%
• 灵活性: 兼容商业化细胞培养基
• FectoVIR®-AAV:严格的生产和质控标准
• GMP级产品:正在开发中
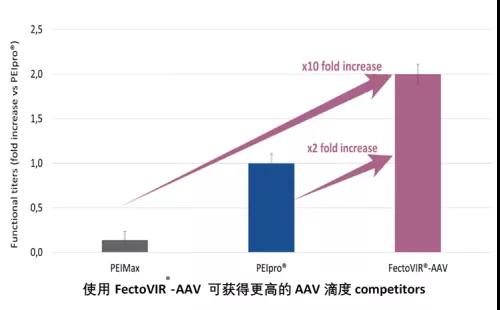
FectoVIR ®-AAV转染试剂的开发经过了的大量优化改进的实验验证,在这一过程中,Polyplus也同时将它与病毒生产的金标准(PEIpro®转染试剂)进行了比较。FectoVIR® -AAV与PEIpro®相比,rAAV产量增加了2倍;和其他竞争对手相比, rAAV提高了10倍 。
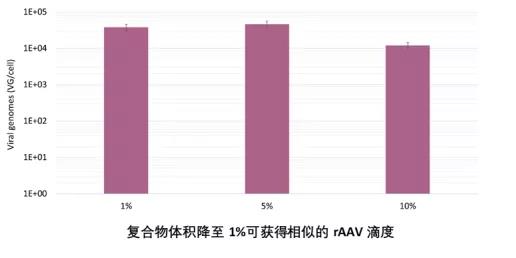
• 最终细胞培养体积
通常,转染复合物体积占最终细胞培养体积的10%,这在扩大生产时可能会导致技术限制。优化后的FectoVIR ®-AAV将复合物体积降低到1%,为大规模生产转染复合物的制备提供了便利。
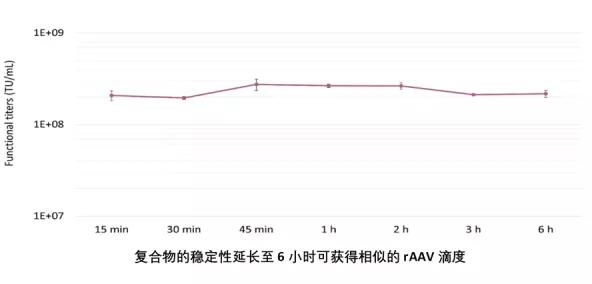
• 转染时间和病毒滴度
有了FectoVIR® -AAV,转染时间不再是导致病毒滴度产量变化的限制因素。FectoVIR® -AAV转染复合物表现出极高的稳定性:将FectoVIR® -AAV转染试剂与质粒DNA混合后,转染复合物可以在6h内添加到细胞中,rAAV滴度产率无明显变化。
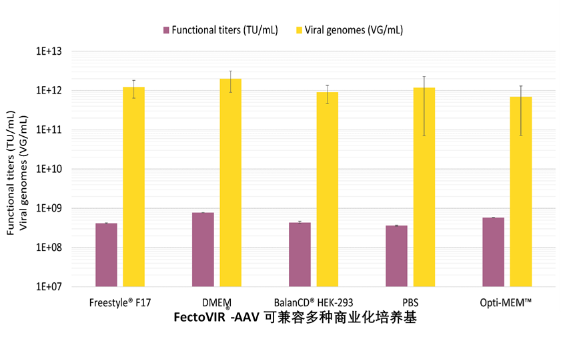
对于每个rAAV生产平台,细胞培养基的选择是特定的。FectoVIR -AAV/DNA复合物的已经在多种不同的商业培养基中进行了测试,并显示出较好的rAAV滴度。
作为一家专业的转染试剂研发和生产公司,Polyplus-transfection®拥有近20年的转染经验,所开发的转染试剂可满足处于各个阶段的客户,从初期的工艺流程开发,到临床前研究以及临床试验以及商业化。其开发的用于基因治疗和细胞治疗领域的病毒载体生产试剂PEIpro®系列产品已经越来越广泛的应用到了众多的临床试验中并成为了行业的金标准。
参考资料:
Passage Bio公司官网